
Farmacovigilancia y la gestión de casos de eventos adversos
La inconsistencia en el proceso de reporte de los eventos adversos es un problema frecuente que puede tener consecuencias económicas importantes para las compañías farmacéuticas
El aumento en el volumen de casos de eventos adversos y el crecimiento exponencial de la cantidad de datos para su procesamiento está cambiando el paradigma de la farmacovigilancia.

¿Qué resolvemos?
La gestión de los casos en la actualidad se caracteriza por un proceso de reporte deficiente donde se omite información relevante, se falla en el proceso de seguimiento de instrucciones, o se reportan falsos-positivos.
¿Cómo lo resolvemos?
Un sistema inteligente de captura y análisis de datos es fundamental para agilizar el proceso de reporte de eventos adversos, simplificando su captura, reduciendo los errores, e incrementado la calidad y estandarización de los reportes. A través del mismo, se habilita la escalabilidad en volumen, rapidez y calidad de la captura. Además, apoyándose en el uso de tecnología de inteligencia artificial semántica; se acelera el proceso de codificación y análisis con un mayor grado de precisión.
1
Acceso seguro
Ingreso en la plataforma mediante credenciales personalizadas vía web (cloud)..

1

Acceso seguro
Ingreso en la plataforma mediante credenciales personalizadas vía web (cloud).
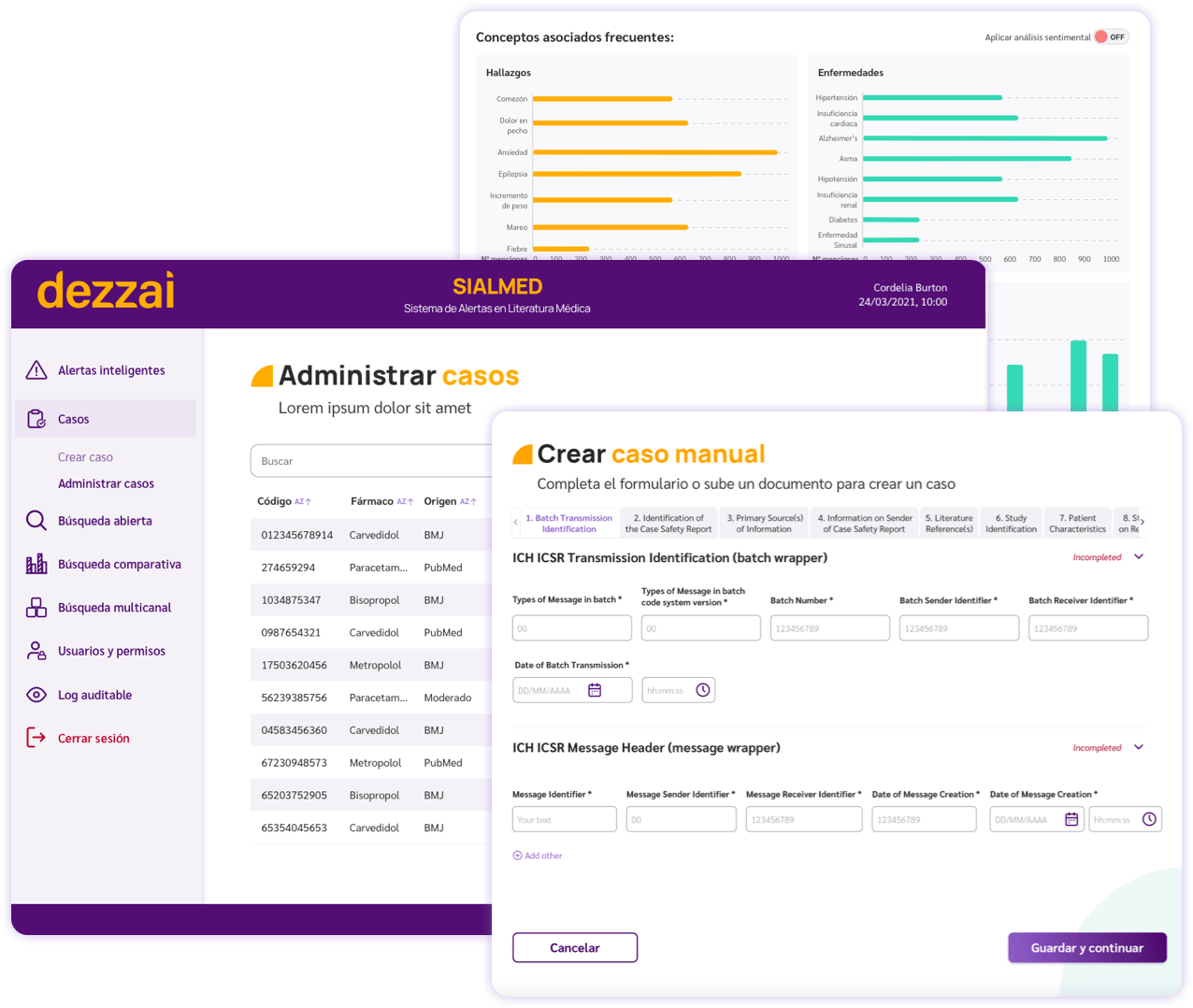
Gestión de casos
Creación y/o modificación del reporte de evento adverso con apoyo de alertas de escritura y lineamientos ICH.
2

Reporte de eventos adversos
Codificación del reporte del evento adverso mediante NMER-ontología Dezzai.
3

3

Reporte de eventos adversos
Codificación del reporte del evento adverso mediante NMER-ontología Dezzai.
Seguimiento individual del caso
Por su estado y prioridad.
4

5
Documentación del proceso del caso
Y/o agrupación por segmentación (Log + Hallazgos).
5

Documentación del proceso del caso
Y/o agrupación por segmentación (Log + Hallazgos).
¿Qué ofrecemos?
- ✅ Acceso seguro
Acceso con credenciales únicas
Gestión de permisos
Reportes auditables - ✅ Formato de captura electrónica
Creación y gestión de reportes adversos según normativa ICH
Alertas de llenado mediante I.A.
Codificación del reporte con terminología MedDRA, CIE-1. - ✅ Gestión de reportes
Segmentación y seguimiento de casos por prioridad y estado.
Reportes exportables XML según normativa por país.
Descarga el folleto
Descárgate gratis nuestro folleto para tener más información sobre el caso de uso:
Otros casos de uso

Farmacovigilancia e IA – Literatura médica

Redacción médica inteligente

Estudios observacionales y ensayos clínicos

Imagen médica

Análisis de texto médico
Estamos aquí para ayudarte
Certificada por:





